段静远/文
日前,国家药监局同日批准两款国产新冠治疗药物,分别是先声的SIM0417(先诺特韦片/利托那韦片组合,商品名:先诺欣)(简称,X药)、君实的VV116(氢溴酸氘瑞米德韦片,商品名:民得维)。
了解,君实VV116此次获批是基于一项于2022年10月完成首例患者入组的JT001-015研究,从首例患者入组到NDA受理用时约88天,再到VV116获批上市约11天。而据注意到,这项新开的试验不同于更早时候开设的JT001-004研究主要终点设置为进展为重症或死亡,JT001-015的主要试验终点设置则是症状恢复。
实际上,截至目前,VV116已经开展了多项临床三期试验,通过临床试验登记网站Clinical Trials以及君实相关公告进行梳理,就适应症而言,包括了轻中度、中重度COVID-19患者治疗;在对照设置上,分别进行了包括安慰剂、Paxlovid以及Favipiravir在内的多个试验;另外在试验终点的也有不同,就主要终点设置来看,分别为症状改善、进展为重度或死亡等。
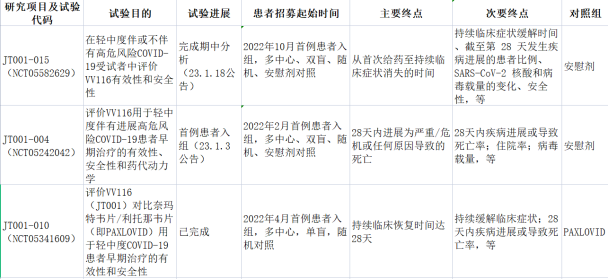
VV116治疗轻中度新冠感染研究梳理/医药健康整理
(综合参考Clinical Trials以及君实相关公告)
此外,VV116还有一项针对重症的研究,从Clinical Trials网站注意到,今年3月该网站上登记了一项针对中重度新冠患者的国际多中心 III 临床研究(登记号:NCT05279235),对照组为Favipiravir。据ClinicalTrials网站信息显示,招募尚未开始。而在君实2022年3月16日的公告显示,已启动一项在中重度COVID-19受试者中评价 VV116 对比标准治疗的有效性和安全性的III 期临床研究,并已完成首例患者入组及给药。
这两项披露的信息或为同一研究,而在君实的公告中最新一次提及中重度研究是在2022年4月29日,目前是否仍在继续尚不可知。
值得一提的是,此次同天获批的两款药物,其靶点分别属于目前新冠治疗药物两个主流阵营3CL与RdRp。
君实VV116则是与默沙东的口服药Molnupiravir以及吉列德的静脉注射药物瑞德西韦均靶向RdRp,而先声X药与辉瑞Paxlovid、盐野义Ensitrelvir均为3CL靶点。
两款药物均是获批用于治疗轻中度病毒感染患者。查阅先声及君实公告注意到,两款药物均是对照安慰剂,主要终点一致,均为症状恢复,也即从首次给药至11种目标COVID-19症状首次持续恢复的时间,持续恢复定义为受试者的11种目标COVID-19症状评分均为0且持续2天;次要终点则都包含了病毒载量。而不同的是,据消息人士表示,先声的X药是用终期试验数据申报,而君实的VV116则是以中期数据申报。
据公司公告中分别披露的两款药物的具体数据来看,VV116的研究结果显示,至期中分析的数据截止日,1277 例受试者,VV116相较安慰剂,主要终点症状改善方面,中位时间差为2天,此外,至持续临床症状缓解时间显著缩短,病毒载量下降等病毒学指标均优于安慰剂组。X药研究结果显示,随机入组1208例受试者,相较安慰剂,主要终点症状改善方面,中位时间约1.5天,其中重症高风险人群亚组可缩短约2.4天。抗病毒效果:用药后第5天,病毒载量下降对比安慰剂最大超96%,核酸转阴时间缩短约2.2天。